ASPECTOS TÉCNICOS DE LA ANTICOAGULACIÓN ORAL
Antonio Acedo Martínez
Sección de Hematología y Hemoterapia
Hospital Vega Baja. Orihuela. Alicante. España.
Resumen
El uso cada vez más frecuente de anticoagulantes orales, a edades cada vez más avanzadas y en múltiples indicaciones, está haciendo que sea más y más frecuente encontrarnos en las consultas a pacientes en tratamiento con estos fármacos. Términos como I.N.R., discrepancias en los rangos de anticoagulación en las mismas indicaciones, diferentes formas de iniciar la anticoagulación, interacciones medicamentosas, actitudes a tomar frente a situaciones clínicas de hemorragias o simplemente exceso de anticoagulación, etc., pueden resultar abstrusas para el no iniciado.
La finalidad que persigue este trabajo es aclarar algunos conceptos y recomendar determinadas pautas de actuación, comúnmente aceptadas. Para ello he revisado la literatura (Medline) de los años 1996 a 1998 y algunos trabajos y publicaciones fuera de este periodo, que por su interés y actualidad me han parecido oportunos.
Solicito la indulgencia del lector porque he considerado insoslayable una aproximación a la fisiología de la hemostasia y a la farmacología de los anticoagulantes, como requisito imprescindible para comprender las motivaciones de ciertas actitudes clínicas y terapéuticas.
Recuerdo fisiológico
La hemostasia es un complejo mecanismo que tiene como finalidad evitar la extravasación de la sangre mediante la formación del coágulo, y su posterior lisis para dejar expedita la circulación. En este proceso se encuentran implicadas diversas estructuras anatómicas: los vasos sanguíneos; celulares: los granulocitos, monocitos, eritrocitos y, fundamentalmente, las plaquetas; proteínas: los factores de la coagulación y fibrinolisis.
Los factores de coagulación se encuentran en el plasma, el endotelio vascular, ciertos órganos y en las células implicadas en la hemostasia. Se las encuentra en forma de proenzimas que una vez activadas, generalmente mediante proteolisis parcial, son transformadas en enzimas, serín proteasas en su mayor parte que, a su vez, activan a otros factores, en un proceso en cascada que culmina, por un lado en la formación del coágulo y, por otro, en la activación de la fibrinolisis y disolución del mismo.
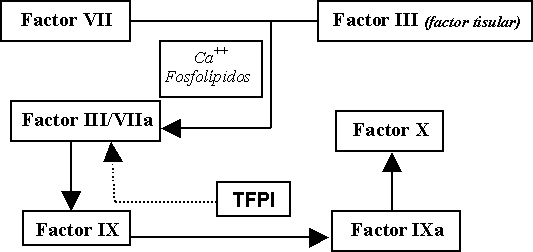
Por motivos pedagógicos se ha clasificado la hemostasia en dos grandes vías: la vía intrínseca (figura 1), cuya activación se realiza en la llamada fase de contacto, mediada "in vivo" por el colágeno y demás proteínas con fuerte carga negativa, y la extrínseca (figura 2), iniciada por el factor tisular o factor III.
Ambas vías se encuentran íntimamente relacionadas entre sí a la altura de la activación del factor IX y, juntas, confluyen en la activación del factor X, verdadera llave que regula la intensidad del proceso de coagulación. La transformación del factor X en factor X activado (FXa), requiere la combinación de una serie de proteínas, lipoproteínas e iones como son el factor V activado (FVa), el calcio y los fosfolípidos. El complejo así resultante es capaz de activar, por proteolisis limitada, el factor II o protrombina a trombina, potentísima enzima eje del sistema de coagulación y fibrinolisis. En los gráficos se han suprimido los inhibidores de la coagulación para mayor claridad.
Figura 1
Vía Intrínseca

Figura 2
Vía extrínseca
Todo este enrevesado sistema está sometido a un complejo proceso de regulaciones, contraregulaciones y retroalimentaciones, de cuyo equilibrio depende la hemostasia y la permeabilidad vascular. La síntesis de los factores de coagulación se realiza, principalmente, en el hígado y endotelio vascular. Los principales factores e inhibidores de la coagulación de síntesis hepática, obviaremos la fibrinolisis por quedar fuera del propósito de este trabajo, son los factores IX, X, V, II, fibrinógeno, proteína C y S, antitrombina III y factor VII. De todos ellos fijaremos nuestra atención en los factores IX, X, VII, II, proteína C y S que son, además de tener un origen común, dependientes de la vitamina K.
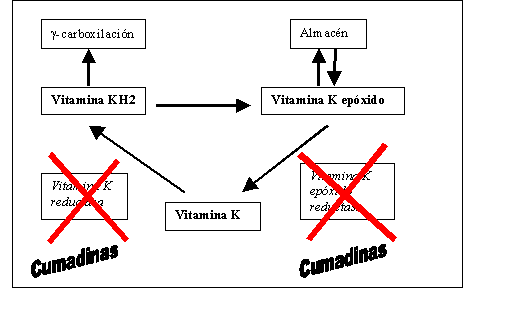
La actividad de la vitamina K sobre dichos factores no está en relación directa con la síntesis de las moléculas, sino con modificaciones de última hora que multiplican por varios logaritmos su actividad. Los factores vitamina K dependientes poseen un residuo de ácido glutámico en el extremo amino-terminal de la molécula y debe ser carboxilado en posición gamma para optimizar su capacidad para formar complejos activos. Esta gammacarboxilación está producida por una carboxilasa que precisa como cofactor a la vitamina K. Los factores no carboxilados se conocen como P.I.V.K.A. (Protein Induced by Vitamin K Absence) y poseen actividad anticoagulante por un mecanismo competitivo sobre los factores carboxilados (figura 3).
La vitamina K (quinona) es transformada después de su absorción en vitamina KH2 (hidroquinona), merced a una vitamina K reductasa, que es el cofactor de la cocarboxilasa dependiente de la vitamina K. La vitamina KH2 es transformada en vitamina K epóxido, siendo almacenada en esta forma. Para ser usada debe ser reconvertida en vitamina K de nuevo, mediante la actividad de una vitamina K epóxido reductasa. Los anticoagulante orales del tipo de las cumadinas actúan inhibiendo la actividad de ambas reductasas: La vitamina K reductasa y la vitamina K epóxido reductasa.
Figura 3
La vitamina K se encuentra ampliamente distribuida en los alimentos, especialmente en los vegetales de hoja verde. Otra fuente muy importante de vitamina K es la proporcionada por la actividad de la flora intestinal normal. Es una vitamina liposoluble, lo que implica que es necesario para su absorción cierto consumo de grasas, como un correcto metabolismo de las mismas. Actualmente disponemos de formas farmacéuticas de vitamina K hidrosoluble (fitomenandiona), administrables por vía endovenosa.
Fármacos anticoagulantes
Farmacología:
Los anticoagulantes orales pertenecen a dos grandes familias de drogas: las cumarinas y las inandionas. Los anticoagulantes cumarínicos (dicumarol y warfarina sódica), son derivados sintéticos de la 4-hidroxicumarina. Los derivados de la inandiona (anisindiona), del indan-1,3-diona. Como se ha indicado antes, ambos grupos actúan inhibiendo la síntesis de los factores II, VII, IX y X, interfiriendo con la gammacarboxilación. El resultado es la síntesis de factores disfuncionales que son detectables con métodos inmunológicos, pero que no muestran actividad coagulante adecuada (P.I.V.K.A.). Al mismo tiempo, y por el mismo motivo, interfieren en la síntesis de las proteínas C y S, lo que tiene importantes implicaciones que luego comentaremos.
A diferencia de la heparina, los anticoagulantes orales no tienen actividad anticoagulante per se. Debido a que estos fármacos no alteran el catabolismo de los factores de coagulación, los efectos anticoagulantes sólo aparecerán cuando se alcance un descenso suficiente de los niveles de dichos factores que dependerán de su tasa individual de degradación. Al mismo tiempo, el descenso de los niveles de proteína C, con actividad inhibidora de la coagulación, dada su vida media más corta, determinará un riesgo tromboembólico aumentado hasta que se alcancen los niveles de anticoagulación necesarios (tabla 1).
Tabla 1
| Proteína | Vida media |
| Factor II | 60 horas o superior |
| Factor VII | 4 a 6 horas |
| Factor IX | 20 a 24 horas |
| Factor X | 48 a 72 horas |
| Proteína C | 6 horas |
| Proteína S | 42 horas |
La warfarina se presenta comercialmente como una mezcla racémica de dos estereoisómeros; R y S, siendo el segundo 5 veces más potente como antagonista de la vitamina K, mientras que el isómero R tiene una vida media más larga, lo que hace que contribuya en mayor medida a los efectos anticoagulantes debido a su acumulación.
Absorción
Se realiza por vía oral, de forma completa en el caso de la warfarina y menos regularmente en el caso de los cumarínicos. Los alimentos disminuyen la tasa de absorción pero no la impiden. También pueden absorberse por vía percutánea, provocando severas intoxicaciones en individuos que manipulan raticidas.
Distribución
Los anticoagulantes orales circulan ligados a las proteínas en un 97 % o más, fundamentalmente a la albúmina, repartiéndose por todo el organismo y cruzando la barrera hematoencefálica y la placenta y alcanzando en el niño niveles plasmáticos similares a los de la madre. El dicumarol y la anisindiona se distribuyen en la leche. Por el contrario no lo hace la warfarina, por lo que es fármaco de lección en las pacientes que amamantan a sus hijos.
Eliminación
In vivo, tanto los derivados de la cumarina, como de la inandiona, como sus diversos isómeros, difieren en la vida media plasmática, el tiempo requerido para alcanzar los niveles deseados de anticoagulación y en la duración del efecto anticoagulante. Por este motivo es necesario someter a los pacientes a un estricto control para asegurar un correcto tratamiento.
Interacciones
Las interacciones farmacológicas son muy frecuentes. Algunos fármacos pueden aumentar la sensibilidad de los pacientes a los A.O.: disminuyendo la síntesis intestinal de vitamina K o interfiriendo con su absorción, distribución o metabolismo; disminuyendo el metabolismo del anticoagulante por inhibición competitiva con los lugares donde se ha de realizar, o inhibiendo la función o la síntesis de las enzimas implicadas en éste; aumentando la afinidad de los anticoagulantes por sus receptores; disminuyendo la síntesis o aumentando el catabolismo de los factores de coagulación; interfiriendo con otros componentes de la hemostasia, como las plaquetas o la fibrinolisis. Otras drogas pueden disminuir la respuesta de los pacientes: disminuyendo la absorción; aumentando el metabolismo por inducción enzimática; aumentando la síntesis de los factores de coagulación.
Debido a la complejidad de las interacciones es difícil predecir la respuesta individual a los fármacos. En la siguiente tabla se muestran algunas de las principales (ver tabla 2)
Tabla 2
| Aumentan la respuesta | ||
| Acetaminofen | Esteroides anabolizantes | Propafenona |
| Ácido aminosalicílico | Estreptoquinasa | Propil-tiouracilo |
| Ácido etacrínico | Fenilbutazona | Propoxifeno |
| Ácido mefenámico | Fenoprofeno cálcico | Quinina |
| Ácido nalidíxico | Fluoroquinolonas | Quinidina |
| Alcohol (intoxicación aguda) | Glucagón | Salicilatos |
| Alopurinol | Hidrato de cloral | Sulfinpirazona |
| Amiodarona | Hormonas tiroideas | Sulfonamidas |
| Antidepresivos tricíclicos | Ibuprofeno | Sulindac |
| Cefamandol | Indometacina | Tamoxifeno |
| Cimetidina | Isoniacida | Tetraciclinas |
| Clofibrato | Ketoprofeno | Tiazidas |
| Cloramfenicol | Lovastatina | Uroquinasa |
| Co-trimoxazol | Meclofenamato | Vacuna antigripal |
| Danazol | Metronidazol | Vitamina E |
| Diazóxido | Miconazol | |
| Diflunisal | Metil-tiouracilo | |
| Disulfiram | Neomicina | |
| Eritromicina | Pentoxifilina | |
| Disminuyen la respuesta | ||
| Alcohol (alcoholismo crónico) | Glutetimida | Rifampicina |
| Aminoglutetimida | Griseofulvina | Espironolactona |
| Barbituratos | Mercaptopurina | Trazodona |
| Carbamazepina | Metaqualona | Sucralfato |
| Corticosteroides | Nafcilina | Vitamina K |
| Corticotropina | Anticonceptivos orales (estrógenos) | |
Presentaciones farmacéuticas
En nuestro país es ampliamente utilizado el acenocumarol (Sintrom ®), en presentaciones de 4 y 1 mg. También disponemos de warfarina (Aldocumar ®) en presentación de 10 mg por comprimido, dosis que resulta inconveniente en pacientes que necesitan dosis pequeñas del anticoagulante.
En los países anglosajones predomina el uso de la warfarina (Marcumar ®), en comprimidos de 1, 3 y 5 mg. Por el contrario, en Francia es de uso habitual el anticoagulante Previscan ®, una anisindiona: fenindiona, presentada en comprimidos de 20 mg.
Las diferencias entre los distintos anticoagulantes han sido señaladas antes, pero pueden resumirse en una mayor semivida para la warfarina, lo que evita oscilaciones en el nivel de anticoagulación, a cambio de presentar problemas de persistencia del efecto en caso de sobredosificación. Lo contrario que el acenocumarol, de semivida más corta y menor persistencia del efecto anticoagulante.
En la tabla 3 se muestran las principales presentaciones internacionales de los anticoagulantes orales, la mayoría en desuso. Se subrayan los más utilizados.
Tabla 3
| Denominación común internacional | Presentaciones | Dosis habitual utilizada | Tiempo de desaparición del efecto (días) |
| Bishidroxicumarina: dicumarol | Dicoumarin
Cumarene Dicumarol Dicumol Trombosan |
25-150 |
5-6 |
| Cumetarol | Dicumoxane |
200 – 1000 |
2 |
| Biscumacetato de etilo | Biscuron
Dicumacyl Stabilene Tromexane |
150-900 |
1-1,5 |
| Warfarina | Aldocumar
Coumadin Marevan Panwarfin Tintorane Warfilone Waran |
2-20 |
4 |
| Acenocumarol | Nicumalone
Sintrom Neo-Sintrom |
2-20 |
2-3 |
| Fenprocumona | Liquamar
Marcumar |
1-10 |
7-10 |
| Fenindiona | Previscan
Dindevan Hedulin Pindione Thrombantin |
25-100 |
3-4 |
| Clorindiona | Indalitan |
2-6 |
3-6 |
| Bromindiona | Halinone
Fluidan |
2-6 |
3-6 |
| Anisondiona | Miradon |
25-300 |
3-4 |
Control de la anticoagulación
Expresión de la actividad anticoagulante
En 1936, Quick observó que el tiempo de protrombina, descrito por él mismo en 1935, se hallaba prolongado en pollos alimentados con dietas carentes en sustancias liposolubles y también cuando la dieta se basaba en el trébol dulce deteriorado, como ya había sido descrito por Schofield en 1922 en el ganado. La sustancia responsable fue aislada por Link en 1941, como cumarol, un derivado de la cumarina.
El uso de los anticoagulantes orales en el tratamiento de la enfermedad tromboembólica se inició en 1941, cuando Butt y sus colaboradores utilizaron el dicumarol por primera vez. El uso clínico de la warfarina se introdujo en 1951.
Desde un principio se hizo evidente el escaso margen terapéutico de estos fármacos y la necesidad de establecer un cuidadoso control analítico. El control del nivel de anticoagulación se realiza mediante el tiempo de protrombina. Consiste en la activación del factor VII mediante un extracto de factor III de diverso origen, añadido de fosfolípidos y calcio iónico: tromboplastina cálcica, y la medida del tiempo de aparición del coágulo de fibrina.
La mayor parte de las tromboplastinas comerciales son extractos de cerebro de diversos animales: conejo, buey, de origen humano, aunque recientemente se han puesto en el mercado tromboplastinas recombinantes. Debido a las diferencias en los métodos de extracción y a la composición de los tejidos, las tromboplastinas obtenidas muestran propiedades procoagulantes muy diferentes.
Por este motivo, desde los primeros tiempos de la descripción del test, se intentó algún tipo de estandarización. En un primer momento se introdujo la expresión del tiempo de protrombina como el porcentaje de la actividad de un lote de plasmas obtenidos de individuos normales, lo que se conoció como índice de Quick.
La falta de reproductibilidad entre las distintas tromboplastinas, y dentro de ellas, entre los distintos laboratorios, hizo que se introdujera la razón (ratio) entre el valor en segundos obtenido en el plasma del paciente y el obtenido con un plasma, o lote de plasmas, reputado como "normal". Los primeros rangos de anticoagulación se establecieron, con tromboplastinas de conejo de muy baja sensibilidad, para razones entre 1,5 y 3,0, en 1942 por Allen y colaboradores, siendo modificados por Quick a valores entre 2,0 y 2,5.
Zucker demostró que el nivel de anticoagulación terapéutico de las tromboplastinas humanas era mucho más elevado que el de las derivadas del cerebro de conejo: razones de 1,8 a 3,0 en las humanas, rango utilizado por los británicos, se correspondían a 1,3-1,7 en las de conejo y razones de 2,0 a 2,5, rangos utilizados en Estados Unidos, con valores de 4,5 a 6,0 con las humanas, lo que resultaba excesivo (tabla 4).
Tabla 4
| Tromboplastina | Nivel terapéutico | Equivalencias |
| Conejo (E.E.U.U.) |
2,0 a 2,5 |
4,5 a 6,0 |
| Humana (G.B.) |
1,8 a 3,0 |
1,3 a 1,7 |
Parecía evidente que el principal problema estaba en la carencia de un método de fabricación de la tromboplastina que proporcionara un producto de características homogéneas. La recomendación del British System of Anticoagulant control del uso de tromboplastinas de cerebro humano, altamente sensibles, llevó al profesor Leon Poller y su equipo a desarrollar la Manchester Comparative Reagent (M.C.R.). Se obtuvo, pues, una tromboplastina sujeta a rigurosos controles de fabricación, de una alta sensibilidad que pudiera ser considerada como reactivo de referencia y que fue utilizada en el reino Unido desde 1970 hasta 1984. Esta tromboplastina fue el embrión de la segunda Tromboplastina de Referencia Primaria de la O.M.S., la B.C.T/253. Así surgió la tromboplastina británica de referencia (B.R.C.) de cerebro humano o el Trombotest de Owren, de cerebro bovino adicionado de plasma bovino absorbido como fuente de factor V y fibrinógeno.
La necesidad de un modelo matemático para que permitiera obtener resultados equivalentes entre reactivos de diferente procedencia se hizo evidente. En 1967 Biggs y Denson propusieron un modelo basado en la correlación lineal entre las razones obtenidas con la tromboplastina a calibrar y otras de referencia, una humana (I.R.P. 67/40), otra bovina y otra de conejo. La ratio corregida así obtenida funcionaba bien para tromboplastinas de sensibilidad similar, pero fallaba cuando se comparaban tromboplastinas de distinta procedencia.
![]()
En 1981 el Bureau of Reference de la Comunidad Económica Europea estableció un nuevo modelo basado en la correlación de los logaritmos de los tiempos obtenidos, en lugar de las razones. Se obtiene así una recta de regresión de la forma:
Lo que equivale a:
![]()
En que ty es tiempo en segundos obtenido con la tromboplastina de referencia y tx el obtenido con la tromboplastina problema, y m el valor de la pendiente de la recta de regresión.
El valor de m es una medida de la sensibilidad de la tromboplastina problema y se conoce como I.S.I. (Indice de Sensibilidad Internacional).
Sustituyendo los tiempos por las razones entre los tiempos obtenidos del paciente y del control y hallando antilogaritmos, se obtiene:

Elevando la razón simple al valor del I.S.I., se obtendrá el valor que se habría conseguido utilizando la tromboplastina de referencia: el I.N.R. o Razón Internacional Normalizada.
Este I.N.R. sólo debe ser utilizado para el control de la anticoagulación oral y nunca en pacientes normales ni para evaluar la función hepática, ya que se calcula a partir de tromboplastinas diseñadas para obtener una alta sensibilidad a los déficits de los factores vitamina K dependiente, y su uso con otros fines podría resultar inconveniente y hasta peligroso.
Todo lo anteriormente descrito se diseñó utilizando el método manual clásico. Recientemente se ha establecido que el valor del I.N.R. sufre modificaciones con los diferentes autoanalizadores, postulándose la conveniencia de realizar calibraciones en los distintos laboratorios de control de anticoagulación, utilizando plasmas frescos o liofilizados,,. También la presencia del anticoagulante lúpico influye en los valores del I.N.R. obtenidos, por lo que algunos autores recomiendan el uso de test que no se vean afectados por él, como el tiempo de protrombina-proconvertina o la medida de la actividad cromogénica del factor Xa.
Actualmente existen varias tromboplastinas calibradas con la I.R.P. 67/40, de distinto origen. Por definición a la tromboplastina I.R.P. 67/40 se le adjudica un I.S.I. de 1,0. Las restantes tromboplastinas se calibran directa o indirectamente frente a ella en estudios multicéntricos. A continuación representamos las relaciones entre las principales tromboplastinas de referencia (figura 4).
Figura 4
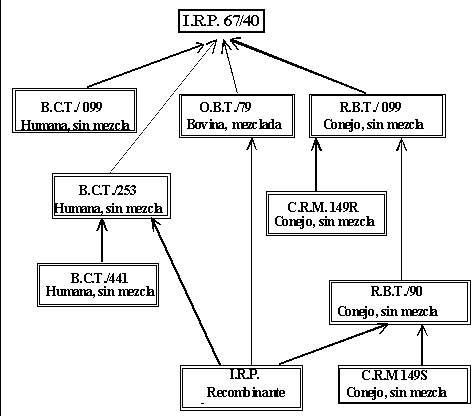
Actualmente la O.M.S. dispone de las siguientes tromboplastinas de referencia: humana C.R.M. 147, bovina C.R.M. 148 y de conejo C.R.M. 149S
Métodos de medida
Fundamentalmente, se utiliza el tiempo de protrombina, que se realiza mediante la mezcla de plasma o sangre total, anticoagulados con citrato sódico al 3,8% en proporción 9:1, con tromboplastina cálcica (tromboplastina más calcio), o con sangre total sin anticoagular y tromboplastina sin adición de calcio, y midiendo el tiempo en que se produce la aparición del coágulo de fibrina. Mide la vía extrínseca y se puede realizar con métodos manuales, en tubo de vidrio, o con sistemas más o menos automatizados, mediante extracción venosa, o con sangre capilar.
En nuestro Hospital utilizamos, habitualmente, el Trombotest de Owren (Nycomed ®), de gran sensibilidad (I.S.I. de alrededor de 1,01), técnica semimicro, con muestras obtenidas por punción capilar y un coagulómetro semiautomático KC4 de Amelung. Nuestra experiencia es buena, aunque requiere personal entrenado y una escrupulosa estandarización del procedimiento. Como ventajas debemos señalar: la comodidad para el paciente, lo escasamente traumático del proceso y la rapidez en la obtención y entrega de resultados (hora u media en total para atender a unos 40 – 50 pacientes). También el bajo consumo de reactivo: 125 µL por determinación, lo que abarata el procedimiento. Como aspectos negativos la necesidad de un técnico y un facultativo, dedicados en exclusiva a dicho menester, durante la hora y media de duración de la consulta.
Otros métodos de medida de la actividad anticoagulante son la determinación del fragmento 1+2 de la protrombina: resto proteico que se libera al formarse la trombina, la cuantificación directa de los factores dependientes de la vitamina K y otras técnicas indirectas que evalúan la presencia de coagulación intravascular, como los complejos trombina-antitrombina III y los niveles de dímero D. Su uso se restringe, casi exclusivamente, a la investigación.
Aspectos clínicos
Inicio de la anticoagulación:
Como se ha señalado antes, debido a la diferente semivida de los factores vitamina K dependientes, durante las primeras horas de iniciarse la anticoagulación se produce un déficit relativo de proteína C y factor VII, que conlleva cierta tendencia procoagulante en los pacientes. Dicha tendencia puede verse agravada en aquellos individuos con déficit congénito de proteína C, en los que se puede desencadenar un cuadro catastrófico de coagulación intravascular diseminada (necrosis dérmica). Por todo ello se recomienda, en todos los casos, iniciar la anticoagulación oral simultaneando la heparina fraccionada o sin fraccionar, con los anticoagulantes orales.
Con respecto a la duración del tratamiento previo con heparina, ha quedado bastante bien establecido que no es necesario superar los días precisos para alcanzar un nivel de anticoagulación adecuado con los anticoagulantes orales, habitualmente 4 o 5.
Se acepta de forma casi unánime que no es recomendable utilizar dosis de carga al iniciar la anticoagulación pues, si bien acorta ligeramente el tiempo que se tarda en conseguir el I.N.R. correcto, no compensa el riesgo hemorrágico al sobrepasar los márgenes de seguridad.
La dosis a utilizar depende del tipo de anticoagulante usado, factores personales como el peso, talla y metabolismo individual de la vitamina K y de costumbres alimentarias del medio sociológico del paciente: en nuestros pacientes, utilizando acenocumarol (Sintrom), la dosis oscila entre los 2 y los 52 mg/semana, con una dosis media de 15 mg/semana.
La frecuencia del control dependerá de la estabilidad de la anticoagulación y de la existencia o no de factores de riesgo asociados.
Resistencia a los anticoagulantes orales
Los motivos por los que los pacientes pueden mostrar una aparente resistencia a los anticoagulantes orales, pueden resumirse en dos grandes grupos:
Resistencia adquirida:
Habitualmente debida a un aumento en la ingesta de vitamina K de origen medicamentoso o con los alimentos (dietas para adelgazar, ricas en verduras). Otro subgrupo abarcaría a aquellos pacientes con alteraciones en el metabolismo del anticoagulante, como disminución de la absorción o aumento del aclaramiento. También algunas drogas son capaces de inhibir el efecto de los anticoagulantes: colestiramina que disminuye la absorción, los barbituratos, alcohol, aloperidol, griseofulvina y el meprobamato que aumentan la biotransformación del isómero S de la warfarina. Algunos fármacos pueden interferir aumentando la síntesis de factores de coagulación, como los contraceptivos orales y los corticosteroides.
Resistencia hereditaria
Se ha postulado que es causada por la presencia de una enzima anormal o un receptor que muestra una afinidad disminuida por los cumarínicos o aumentada por la vitamina K. Esta forma de resistencia es extremadamente rara y ha sido descrita en un escaso número de pacientes.
La actitud terapéutica depende del tipo de resistencia: ajustes en la dieta o en el tratamiento del paciente solventarán el problema en un gran número de casos. En otros el cambio de aumento de la dosis de anticoagulante o el cambio entre grupos distintos puede resultar una aproximación aceptable.
Indicaciones y rangos de anticoagulación
Las principales indicaciones para el uso de los anticoagulantes orales son: profilaxis y tratamiento de la T.V.P. y del embolismo pulmonar, prevención y tratamiento del infarto de miocardio, prevención del embolismo cerebral, profilaxis en la enfermedad valvular cardíaca, prevención de los episodios embólicos en la fibrilación auricular con o sin valvulopatía reumática, tratamiento de la enfermedad arterial periférica y profilaxis en los reemplazamientos valvulares totales.
A mediados de los años 80, distintas sociedades científicas y grupos de consenso postularon diversos rangos de anticoagulación, que se podrían resumir en (tabla 5).
Tabla 5
| Indicaciones | British Society of Haematology | Leuven Consensus Group | Leiden Thrombosis Centre |
| Profilaxis perioperatoria |
2,0-2,5 |
1,5-2,5 |
1,5-2,5 |
| Tratamiento T.V.P. y E.P. |
2,0-3,0 |
2,0-3,0 |
2,0-4,0 |
| Prevención de embolismo arterial |
3,0-4,5 |
2,0-4,0 |
3,0-4,5 |
| Prótesis valvulares |
3,0-4,5 |
3,0-4,5 |
3,5-5,0 |
La evidente relación entre el nivel de anticoagulación y los problemas hemorrágicos17, en ocasiones graves (tabla 6), y la introducción de prótesis valvulares de bajo perfil, superficies inertes, etc., ha movido a los autores a revisar los rangos de anticoagulación con el fin de reducir, en lo posible, los riesgos.
Tabla 6
| Estudio | Pacientes | Duración del tratamiento | Rango terapéutico (I.N.R.) | Pacientes con hemorragia (%) |
p |
Pacientes con sangrado mayor (%) |
p |
| Turpie et
al.
Bioprótesis |
210 |
3 meses |
2,5 a 4 v.s. 2,0 a 2,3 |
13,9 v.s. 5,9 |
< 0,0043 |
4,6 v.s. 0 |
< 0,034 |
| Saour et al.
Válvulas mecánicas |
247 |
3,47 años |
7,4 a 10,8 v.s. 1,9 a 3,6 |
42,4 v.s. 21,3 |
<0,002 |
7,2 v.s. 3,3 |
n.s. |
El comité ad hoc de la Sociedad Europea de Cardiología estableció en 1993 los siguientes criterios de para la anticoagulación de los pacientes con prótesis valvulares (tabla 7).
Tabla 7
| Indicación |
I.N.R. |
| Válvulas mecánicas de primera generación: Starr-Edwards, Björk-Shiley estándar |
3,0 – 4,5 |
| Válvulas mecánicas de segunda generación: St. Jude, Medtronics, Monostrut |
2,5 – 3,5 |
| Bioprótesis en ritmo sinusal |
No anticoagular después de 3-6 meses |
| Bioprótesis en fibrilación auricular |
3,0 – 4,6 |
| Enfermedad valvular reumática en ritmo sinusal pero con otros factores de riesgo |
2,5 – 3,0 |
En las prótesis valvulares de segunda generación en posición aórtica se considera suficiente una anticoagulación moderada con I.N.R. entre 2,0 y 3,0.
En los últimos años hay cierta controversia sobre la posibilidad de establecer tratamientos con baja intensidad de anticoagulación en pacientes con fibrilación auricular no reumática,,, sobre todo en aquellos de edad superior a los 75 años, con dosis fijas que no precisarían control por el laboratorio, aunque algunos autores encuentran una mayor incidencia de accidentes cerebro-vasculares de origen embólico, que no compensaría la reducción del riesgo hemorrágico.
Complicaciones y efectos secundarios
La principal complicación es la hemorragia, aproximadamente un 3 % de episodios hemorrágicos graves por paciente/año que, en ocasiones, pueden comprometer la vida de los pacientes. Son mucho más frecuentes las pequeñas hemorragias, entre el 2 y el 10% de los pacientes las sufren, como hematomas, gingivorragias, epistaxis, etc.
Ante situaciones como las descritas, la actitud a tomar dependerá de la gravedad del proceso. En situaciones leves bastará una ligera reducción de la dosis de anticoagulante, para situar al paciente en la parte baja del rango. Otras veces, medidas higiénicas, como una limpieza de boca, serán suficientes.
Cuando el cuadro puede comprometer la vida o la función de algún órgano importante, el tratamiento se apoya, sucesivamente, en una serie de medidas: suspender el tratamiento anticoagulante, administrar pequeñas dosis de vitamina K por vía oral o parenteral, entre 3 y 5 mg, y la administración de plasma fresco congelado o factores de coagulación (complejo protrombina activado), sobre todo si es necesaria una intervención quirúrgica. Si se produce una sobredosificación de fitomenandiona (vitamina K1), el paciente puede volverse refractario a la acción de los A.O. durante varios días o semanas.
Otras complicaciones del uso de los A.O. son: la necrosis y/o gangrena de la piel por infartos subcutáneos, que suelen observarse la primera vez que se administra el fármaco, en pacientes con déficit familiar de proteína C o S. El uso de heparina al inicio de la anticoagulación, durante cuatro o cinco días, reducirá el riesgo de necrosis.
Se ha descrito la posibilidad de que, en ciertos pacientes, el uso de derivados de la cumarina pueda provocar una fragmentación de las placas de ateroma, dando lugar a microembolias de colesterol y síndrome de los dedos púrpura. Aunque el cuadro es reversible se han descrito casos que han evolucionado hasta la gangrena, por lo que se recomienda suspender el tratamiento. También se pueden presentar cuadros de embolismo sistémico que dan lugar a livedo reticularis, dolores en pies y abdominales, lumbalgias, hematurias, insuficiencia renal, etc., todos ellos de causa tromboembólica.
Otros efectos secundarios poco frecuentes son las nauseas y vómitos, anorexia, calambres abdominales y diarrea. La dermatitis ha sido descrita con cierta consistencia, más frecuente con la anisindiona y fenindiona. Ocasionalmente, urticaria, alopecia, fiebre, cefaleas, leucopenia, agranulocitosis, aumento de las transaminasas, fosfatasa alcalina, reacciones anafilácticas, hepatitis tóxica, y una larga lista de efectos secundarios esporádicos. También anomalías en el metabolismo óseo del calcio, lo que tendría importancia en pacientes de edad avanzada en tratamiento crónico con anticoagulantes orales.
Los anticoagulantes orales están contraindicados durante el embarazo. Se han descrito hemorragias fetales con muerte intrauterina y neonatal. Hipoplasia de las estructuras nasales y otras anomalías consistentes con condrodisplasia punctata han sido descritas en niños cuyas madres han tomado A.O. durante el primer trimestre del embarazo. También malformaciones del S.N.C. por anomalías en la línea media dorsal o ventral: agenesia del cuerpo calloso, malformación de Dandy-Walker, atrofia cerebelosa, atrofia óptica, etc. Retraso mental ceguera y otras anomalías se han encontrado en hijos de pacientes que han recibido A.O. durante el tercer trimestre.
En general se contraindica el uso de A.O. durante el embarazo, pudiendo ser sustituido por heparina que no cruza la placenta. En caso de ser necesaria su administración se evitará durante el primer trimestre y últimas semanas de gestación.
Si se ha de administrar durante la lactancia se prefiere el uso de warfarina que no se elimina con la leche.
Ajustes de dosis
Los controles se realizarán con una cadencia que deberá ser ajustada a cada caso particular. En aquellos pacientes de comportamiento estable bastará con un control cada 4 u 8 semanas. Por el contrario, pacientes con resultados erráticos, con hepatopatías subyacentes, trombopenias u otras patologías que puedan ser causa de diátesis hemorrágica, se reducirá en plazo de control como se estime conveniente.
Cuando se detecte un control fuera del rango esperado, se recabará información sobre el uso de nuevos fármacos, principalmente aquellos con actividad reconocida frente a los anticoagulantes orales (tabla 3), errores en la posología, cambios en la dieta, etc.
Los ajustes deberán hacerse con precaución, no superando, en general, el 20 % de la dosis previa, teniendo en cuenta siempre, la distancia entre valor obtenido y el esperado. También la presencia o no de clínica hemorrágica y su importancia.
En aquellos casos en que el I.N.R. no supere el valor de 6, bastará con reducir la dosis entre un 10 y un 15 %. Si el paciente presenta clínica hemorrágica de leve a moderada, poco frecuente con estas cifras, se añadirán 2 o 3 mg de fitomenandiona por vía oral. Podría, además, ser de utilidad el uso de inhibidores de la fibrinolisis en uso tópico: colutorios en caso de gingivorragias, o sistémico. En casos de hematuria, se indicará reposo.
Cuando el I.N.R. supere el valor de 6 se administrará vitamina K1 a dosis inferiores a 5 mg, generalmente por vía oral, reduciéndose la dosis en hasta un 20 % o más, si fuera necesario.
En casos de hemorragia grave, real o potencialmente, se recurrirá al rescate con vitamina K y al uso de plasma fresco congelado, en cantidad suficiente para mantener un I.N.R. inferior a 1,5, previo ingreso hospitalario.
Bibliografía
1 AHFS, Drugs Information, (1998) 1157-1163.
2 Quick A.J., Stanley Brown M., Brancroft F.W. A study of the coagulation defect in the hemophilia and jaundice. Am J Med Sci 1935; 190: 501.
3 Zucker S., Cathey M.H., Sox P.J., Hall E.C. Standardization of laboratory test for controling anticoagulant therapy. Am J Clin Pathol 1970; 53: 384.
4 Poller L. European Concert Action on Anticoagulation (ECAA). Haemostasis 1996; 26 (suppl 4): 266-268
5 Anthony R. Hubbard, Sarah M.L. Margetts and Trevor W. Barrowcliffe. International Normalized Ratio determination using calibrated reference plasmas. British Journal of Haematology 1997; 98:74 -78.
6 Use of plasma from donors under oral anticoagulante treatment for the expression of INR values. Haematologica. 1997 Sep.; 82 (5): 630-633.
7 System ISI calibration: a universally applicable scheme is posible only when coumarin plasma calibrants are used. British Journal of Haematology 1997; 96:435 -441.
8 Mool S., Ortel T.L. Monitoring warfarin therapy in patients with lupus anticoagulants. Ann Intern Med. 1997; 127:177-185.
9 A.M.H.P. van den Besselaar. Precision and accuracy of the International Normalized Ratio in oral anticoagulant control. Haemostasis 1996; 26 (suppl 4): 248-265.
10 Anticoagulation clinics: the italian experience. Haematologica. 1997 Nov.; 82 (6): 713-717.
11 Weeranuj Yamreudeewong, James V. Johnsosn, Thomas G. Cassidy and Jean T. Berg. Comparison of two methods for INR determination in a pharmacist-based oral anticoagulant Clinic. Pharmacotherapy. 1996 Nov; 16(6): 1159-1165.
12 José l. Navarro, Jesús M. César, Luis J. García Frade, Ana Pardo, Ángel G. Avello, Rosa Trejo, Jesús Villarubia, Javier López. Control de la anticoagulación oral en sangre capilar. Sangre 1994; 39(4): 257-260.
13 J.W.J. van Wersch, C.H. van Mourik-Alderliesten, A. Coremans. Comparison of markers of coagulation activation in patiens under oral anticoagulation different levels. Eur. Clin. Chem. Clin. Biochem. 1992; 30: 461-466.
14 Hull RD, Raskob GE, Rosembloom D. Heparin for 5 days as compared with 10 days in the initial treatment of proximal venous thrombosis. N Engl. J. Med. 1990; 322: 1260-1264.
15 Antonio Amian, Juan Nicolás Rodríguez, Raquel Muñiz, José Carlos Diéguez, Manuel Cañavate, Antonio Fernández Jurado, María Luz Martino, Dalmiro Prados. Tratamiento con anticoagulantes orales (acenocumarol): influencia de la dosis inicial en la incidencia de episodios hemorrágicos y tromboembólicos. Sangre 1994; 39(6): 413-416.
16 Michelle L. Hurse. Warfarin resistence: Diagnosis and therapeutic alternatives. Pharmacotherapy 1996 Nov; 16(6): 1009-1017.
17 Turpie A.G.G., Gunstensen J., Hirsh J., Nelson H., Gent M. Randomisierter Vergleich zweier Dosierungsstärken zur oralen Antikoagulantientherapie nach Bioklappenersatz. The Lancet (edición alemana) 1988; 2:587-590.
18 Saour J.N., Sieck J.O., Mamo L.A.R., gallus A.S.. Trial of different intensities of anticoagulantion in patientes with Prosthetic heart valves. N England J Med. 1990; 322: 428-432.
19 Ad hoc Commitee of the Working Group on Valvular Heart Disease, European Society of Cardiology. Guidelines for prevention of tromboembolic events in valvular heart disease. J. Heart Valve Dis. 1993; 2: 398-410.
20 European Atrial Fibrillation Trial Study Group. Secondary prevention in non.rheumatic atrial fibrillation after transient ischaemic attack or minor stroke. Lancet 1993: 342: 1255-1256.
21 Rosebberg W, Donald A. Evidence based medicine. An approach to clinical problem solving. BMJ 1995; 310: 1122-1126.
22 Low intensity warfarin therapy. Haematologica. 1997 Nov.; 82 (6): 710-712.
23 Lancaster T, Jonathan M, Singer D.E. Stroke prevention in atrial fibrilation. BMJ 1997; 1563 (31 May)
24 Weibert R.T., Lee D.T., Kayser S.R., Rapaport S.I. Correction of excesive anticoagulation with low-dose oral vitamina K1. Ann Intern Med. 1997; 125: 959-962.
25 Vermeer C. Effects of vitamina K and oral anticoagulants on calcium metabolism. Simposium Internacional sobre la utilización de los anticoagulantes orales en Europa. Nov. 1993. F.M. Gráfico Barcelona 1994. Pags: 19-29.